 Puesto que, las células están constituidas por una gran variedad de moléculas complejas, denominadas macromoléculas biológicas, tales como los carbohidratos, los lípidos, las proteínas y los ácidos nucleicos (que comenzaré a tratar ampliamente a partir de la siguiente entrada dentro de esta sección), y debido a que en dichas macromoléculas el carbono es su componente esencial, dedicaré este apartado a un estudio breve de este elemento químico.
Puesto que, las células están constituidas por una gran variedad de moléculas complejas, denominadas macromoléculas biológicas, tales como los carbohidratos, los lípidos, las proteínas y los ácidos nucleicos (que comenzaré a tratar ampliamente a partir de la siguiente entrada dentro de esta sección), y debido a que en dichas macromoléculas el carbono es su componente esencial, dedicaré este apartado a un estudio breve de este elemento químico.El carbono (C) con un número atómico 6 (6 protones y 6 electrones), presenta su capa más externa incompleta con cuatro electrones en la misma. De este modo, con esos cuatro electrones desapareados puede llegar a formar hasta cuatro enlaces covalentes con otros átomos, satisfaciendo así la regla del octeto. Esta propiedad permite al carbono convertirse en un elemento químico muy versátil, ideal como componente estructural o esqueleto de las macromoléculas.
Hidrocarburos
Son moléculas orgánicas[1] constituidas en su totalidad por carbono e hidrógeno. Los enlaces covalentes que se forman entre los átomos de estas moléculas liberan una gran cantidad de energía cuando se queman (oxidan), ésta es la razón por la que empleamos los hidrocarburos como combustibles en nuestra vida diaria, ejemplo de ello son los gases propano y butano.
Cada uno de los enlaces covalentes que se crean entre los átomos de carbono pueden ser simples, dobles o triples, influyendo este hecho en la geometría o forma global de la molécula, la cual, a su vez tendrá una influencia fundamental en las propiedades y funciones que los hidrocarburos pueden llegar a desarrollar. Encontramos, por ejemplo, que los átomos de carbono que forman enlaces simples crean formas tetraédricas permitiendo la rotación de la molécula a lo largo del eje de enlace. En cambio, cuando se constituye un enlace doble o triple la estructura que se adopta es plana y lineal respectivamente.
▣ Hidrocarburos de cadena (alifáticos): constituidos por enlaces sucesivos entre átomos de carbono que pueden ser ramificados o sin ramificar.
▣ Hidrocarburos de anillo (aromáticos): consisten en anillos cerrados de cinco o seis átomos de carbono. En ocasiones, este tipo de estructuras aparecen en hidrocarburos con enlaces dobles como el ciclohexano o el benceno, poseyendo este último una importancia básica en moléculas biológicas como algunos aminoácidos, el colesterol o sus derivados (las hormonas testosterona y estrógeno).No obstante, hay que señalar que tal división entre hidrocarburos no es excluyente, sino que algunos presentan en su estructura tanto fragmentos alifáticos como aromáticos; es el caso del beta-caroteno, potente antioxidante, precursor de la vitamina A tan presente en frutas, verduras y cereales.
▣ Isómeros estructurales que se diferencian por la ubicación de sus enlaces covalentes. Así, el butano y el isobutano cuentan ambos con cuatro átomos de carbono y diez de hidrógeno (C4H10), pero la distinta disposición de los átomos dentro de la molécula conduce a diferencias en sus propiedades químicas. Mientras el primero de ellos, el butano, se utiliza como combustible, el segundo es más adecuado como refrigerante.
▣ Isómeros geométricos se diferencian en cómo los átomos se configuran en torno a los dobles enlaces C=C. De esta manera, hablaremos de configuración cis cuando encontramos los mismos grupos de átomos al mismo lado del doble enlace carbono-carbono y configuración trans cuando se localizan en lados opuestos. En esta segunda configuración, los átomos de carbono dan lugar a una estructura molecular más o menos lineal, mientras que en la primera originan una curvatura (cambio de dirección) en dicha estructura.
Los hidrocarburos se encuentran divididos, principalmente, en dos categorías:
▣ Hidrocarburos de cadena (alifáticos): constituidos por enlaces sucesivos entre átomos de carbono que pueden ser ramificados o sin ramificar.
▣ Hidrocarburos de anillo (aromáticos): consisten en anillos cerrados de cinco o seis átomos de carbono. En ocasiones, este tipo de estructuras aparecen en hidrocarburos con enlaces dobles como el ciclohexano o el benceno, poseyendo este último una importancia básica en moléculas biológicas como algunos aminoácidos, el colesterol o sus derivados (las hormonas testosterona y estrógeno).
Isómeros
Moléculas que comparten la misma fórmula química pero difieren en la estructura o localización de sus átomos y/o enlaces químicos. Se distinguen dos tipos:
▣ Isómeros estructurales que se diferencian por la ubicación de sus enlaces covalentes. Así, el butano y el isobutano cuentan ambos con cuatro átomos de carbono y diez de hidrógeno (C4H10), pero la distinta disposición de los átomos dentro de la molécula conduce a diferencias en sus propiedades químicas. Mientras el primero de ellos, el butano, se utiliza como combustible, el segundo es más adecuado como refrigerante.
▣ Isómeros geométricos se diferencian en cómo los átomos se configuran en torno a los dobles enlaces C=C. De esta manera, hablaremos de configuración cis cuando encontramos los mismos grupos de átomos al mismo lado del doble enlace carbono-carbono y configuración trans cuando se localizan en lados opuestos. En esta segunda configuración, los átomos de carbono dan lugar a una estructura molecular más o menos lineal, mientras que en la primera originan una curvatura (cambio de dirección) en dicha estructura.
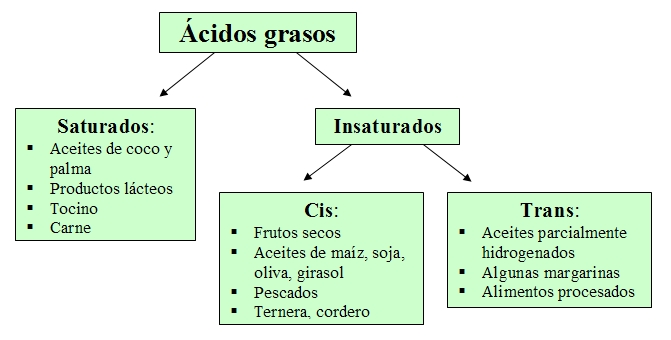
Los triglicéridos[2] (grasas y aceites) se van a clasificar en función de los ácidos grasos[3] que contienen. Así, aquellos ácidos grasos que cuentan al menos con un doble enlace uniendo sus átomos de carbono dan lugar a las llamadas grasas insaturadas. Cuando alguno de estos enlaces se halla en la configuración cis, las moléculas de los triglicéridos no pueden agruparse ni compactarse, por lo que se mantienen en estado líquido a temperatura ambiente (aceites).
Por otro lado, aquellos triglicéridos con doble enlace de tipo trans (popularmente denominados grasas trans), poseen unos ácidos grasos relativamente lineales que sí son capaces de compactarse fuertemente a temperatura ambiente formando grasas sólidas manufacturadas como aceites parcialmente hidrogenados, alimentos procesados y algunas margarinas. En la dieta humana estas grasas están asociadas a un incremento en las enfermedades cardiovasculares, por lo que han sido ampliamente reducidas y/o eliminadas en gran parte de la industria alimentaria.
En contraste con las grasas insaturadas, aquellos triglicéridos cuyos ácidos grasos no tienen átomos de carbono unidos entre sí por un doble enlace se conocen como grasas saturadas. Se denominan de esta manera porque con el término saturado se indica que cada carbono de la cadena está saturado con hidrógeno: no pueden enlazarse más hidrógenos a ese carbono. Estas grasas suelen solidificarse a temperatura ambiente y se hallan en alimentos de origen animal, la leche y sus derivados e incluso en algunos aceites de origen vegetal como los de coco y palma.
Enantiómeros
Moléculas con los mismos enlaces e idéntica estructura química pero con distinta localización de sus átomos, de tal modo que son imágenes especulares la una de la otra. Un ejemplo serían las formas D y L de algunos aminoácidos, con funciones muy distintas ya que, mientras la segunda dará lugar a la constitución de proteínas, la primera formará parte de las paredes celulares de algunas bacterias.
Grupos funcionales
Grupos de átomos que aparecen dentro de las moléculas confiriéndolas unas propiedades químicas específicas. Así, cada uno de los cuatro tipos de macromoléculas biológicas (carbohidratos, lípidos, proteínas y ácidos nucleicos) tiene su propio conjunto de grupos funcionales que les dotan de unas propiedades químicas y funciones muy características dentro de los organismos vivos.
Estos grupos se van a unir en varios puntos a la columna vertebral de las macromoléculas a través de su estructura lineal en cadena y/o en anillo.
Los grupos funcionales se suelen clasificar, dependiendo de su carga o polaridad, en hidrofóbicos (moléculas no cargadas que no interaccionan bien con moléculas polares como el agua) e hidrófilos (iones o moléculas polares que sí interaccionan bien con otras moléculas polares).
Estos grupos se van a unir en varios puntos a la columna vertebral de las macromoléculas a través de su estructura lineal en cadena y/o en anillo.
Los grupos funcionales se suelen clasificar, dependiendo de su carga o polaridad, en hidrofóbicos (moléculas no cargadas que no interaccionan bien con moléculas polares como el agua) e hidrófilos (iones o moléculas polares que sí interaccionan bien con otras moléculas polares).
[1] Aquellas que contienen cualquier forma de carbono, ya sea sólida, líquida o gaseosa y que son primordiales para la vida.
[2] Compuesto constituido por una molécula de glicerol que actúa como esqueleto a la que se une tres moléculas de ácidos grasos.
[3] Cadenas de larga longitud, normalmente, de 16 a 22 átomos de carbono, con una estructura mayoritariamente hidrófoba que la impide disolverse en agua. Como grupo funcional cuenta con un grupo carboxilo que presenta carácter ácido.
[2] Compuesto constituido por una molécula de glicerol que actúa como esqueleto a la que se une tres moléculas de ácidos grasos.
[3] Cadenas de larga longitud, normalmente, de 16 a 22 átomos de carbono, con una estructura mayoritariamente hidrófoba que la impide disolverse en agua. Como grupo funcional cuenta con un grupo carboxilo que presenta carácter ácido.
Fuente: OpenStax College, Biology. OpenStax College. 30 May 2013.
http://perdergrasa.bligoo.es/clasificacion-de-trigliceridos
http://recursos.cnice.mec.es/biosfera/alumno/2bachillerato/biomol/contenidos9.htm
http://biomodel.uah.es/model2/lip/acgr-salud.htm
http://perdergrasa.bligoo.es/clasificacion-de-trigliceridos
http://recursos.cnice.mec.es/biosfera/alumno/2bachillerato/biomol/contenidos9.htm
http://biomodel.uah.es/model2/lip/acgr-salud.htm







Tu opinión es importante
Estás invitado a enviar cualquier comentario o aportación que quieras realizar, gracias.